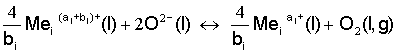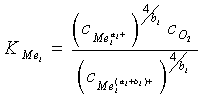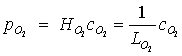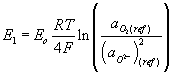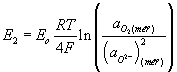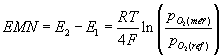Stanovení parciálního tlaku kyslíku ve sklovině
Cílem laboratorní práce je seznámit se s metodou měření redox stavu skloviny. Redox (oxidačně-redukční) stav skla vyjadřuje koncentraci fyzikálně rozpuštěného kyslíku a poměr mezi oxidačně-redukčními stupni polyvalentních prvků přítomných ve skle jako čeřící přísady (Na2SO4, Sb2O3, As2O3), barvicí přísady (Cu, Co, Cr, Fe3+, S2-) či jako nečistoty (Fe, Cr, S). Oxidačně-redukční stav složek skloviny lze za rovnováhy popsat následující obecnou rovnicí:
|
|
(1) |
kde ![]() odpovídá prvku s vyšším a
odpovídá prvku s vyšším a ![]() s nižším oxidačním stupněm. Při vyjádření rovnovážné konstanty se aktivity nahrazují koncentracemi, protože se předpokládá ideální chování roztoků (skloviny). Rovnovážná konstanta popisuje kvantitativní přeměnu chemické reakce a platí pro daný polyvalentní prvek za daného složení skla.
s nižším oxidačním stupněm. Při vyjádření rovnovážné konstanty se aktivity nahrazují koncentracemi, protože se předpokládá ideální chování roztoků (skloviny). Rovnovážná konstanta popisuje kvantitativní přeměnu chemické reakce a platí pro daný polyvalentní prvek za daného složení skla.
|
|
(2) |
Koncentraci volných kyslíkových iontů ( ![]() ) zahrnujeme do rovnovážné konstanty
) zahrnujeme do rovnovážné konstanty ![]() , protože při posunu rovnováhy hodnota
, protože při posunu rovnováhy hodnota ![]() zůstává prakticky konstantní.
zůstává prakticky konstantní.
Koncentraci fyzikálně rozpuštěného kyslíku ![]() ve sklovině můžeme vyjádřit pomocí Henryho zákona tlakem kyslíku
ve sklovině můžeme vyjádřit pomocí Henryho zákona tlakem kyslíku ![]() ve sklovině:
ve sklovině:
|
(3) |
kde ![]() je Henryho konstanta závislá na teplotě a složení skloviny. Její převrácená hodnota udává rozpustnost kyslíku ve sklovině
je Henryho konstanta závislá na teplotě a složení skloviny. Její převrácená hodnota udává rozpustnost kyslíku ve sklovině ![]() .
.
Měření redox stavu skloviny
Oxidačně redukční stav skloviny se může stanovit elektrochemickou metodou, kdy se měří elektromotorické napětí (EMN) mezi dvěma elektrodami - měřící, která je ponořena ve sledované tavenině a referenční ve směsi o známém parciálním tlaku fyzikálně rozpuštěného kyslíku. Elektrodovou reakci můžeme vyjádřit rovnicí O2 + 4e- = 2O2- . Přičemž pro potenciál referenční elektrody platí Nernstova rovnice
|
|
(4) |
a podobně pro potenciál měřící elektrody
|
|
(5) |
Pak pro výpočet EMN za předpokladu ideálního chování lze použít vztah:
|
|
(6) |
kde R je plynová konstanta, T je termodynamická teplota a F je Faradayova konstanta. Referenční směsí může být směs Ni/NiO nebo Mo/MoO2 (Rapidox sondy) nebo jiná sklovina (Pt sonda). Měřící elektrodu tvoří Pt nebo Ir drát. Vodivé spojení mezi elektrodami a sklovinou je u Rapidox sondy zajištěno přes zirkoničitý pevný elektrolyt a u Pt elektrody přes malý otvor v křemenné zkumavce. Laboratorní měření probíhá většinou za izotermních podmínek, v rozmezí 1200°C až 1400°C.
|
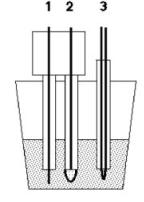
Schéma zapojení Rapidox sondy |
|
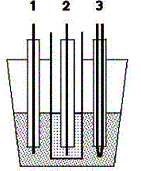
Schéma zapojení Pt sondy |
|
|
1) měřící elektroda 2) referenční elektroda 3) termočlánek
|
|
Znalost teplotní závislosti parciálního tlaku kyslíku použitého referenčního materiálu, umožňuje z hodnot EMN vypočítat parciální tlak kyslíku ve sklovině při dané teplotě. Pro měření Rapidox (Zr) sondou Ni/NiO se použije rovnice:
|
|
(7) |
a pro měření s Pt sondou za použití referenčního skla G2 rovnice:
|
|
(8) |
Význam redox stavu skloviny
Redox stav skloviny má vliv jak na průběh samotného tavícího procesu tak na výsledné vlastnosti skloviny. Redox stav skloviny ovlivňuje průběh odstraňování bublin (čeřící proces), tvorbu pěny, korozi žárovzdorných materiálů, má vliv na výslednou barvu skla a celkově jeho kvalitu. Hodnoty redox stavu skloviny se používají také jako vstupní údaje pro matematické modelování rozložení oxidačně-redukčních stavů složek v tavícím prostoru, k modelování chování bublin a pro identifikaci jejich zdrojů.
Postup měření redox stavu skloviny
- Proměřte danou sklovinu v teplotním intervalu 1200°C – 1400°C po 50°C. Teplotu zvyšte po ustálení EMN. Doba potřebná pro ustálení EMN se liší podle použité skloviny a řádově činí desítky minut.
- Pro každou teplotu najděte “ustálené” hodnoty EMN, vypočítejte průměr. Pro snazší kontrolu vybrané hodnoty v tabulce barevně zvýrazněte.
- Ze získaných hodnot EMN a teploty vypočtěte parciální tlak kyslíku ve sklovině podle typu sondy s použitím rovnice (7) nebo (8). Parciální tlak kyslíku převeďte na Pa.
- Pro každou uvažovanou teplotu vypočtěte rozpustnost kyslíku ve sklovině podle rovnice :
|
|
(9) |
- Koncentraci fyzikálně rozpuštěného kyslíku ve sklovině
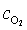 vypočtěte ze vztahu (3).
vypočtěte ze vztahu (3). - Dosazením a úpravou vztahu (2) vypočtěte koncentraci Fe2+ a Fe3+ za předpokladu, že sklovina obsahuje 0,1 hmot.% Fe2O3. Nezapomeňte převést hmot.% Fe2O3 na koncentraci Fe2O3 [mol.m-3] a následně na koncentraci Fe [mol.m-3].
- Výsledky zpracujte do tabulky.
DATA POTŘEBNÁ PRO VÝPOČET:
1 bar = 1 x 105 Pa
K(Fe) = exp(18,397 – 42469/T), T = [K]
r(skla) = 2289 kg.m-3
M(Fe) = 55,847 g.mol-1
M(O2) = 15,999 g.mol-1